Клиническая картина мира
Инвестиции в медицинcкие разработки постоянно растут. Мировые расходы на R&D в области Life Science, по данным Industrial Research Institute (IRI), за последние десять лет увеличились втрое и составили $169,3 млрд в 2016 году. Причем 85% ресурсов приходится на биофармацевтический сектор. По затратам на R&D медицина является лидером наряду с ICT (Information and Communication Technology — $204,5 млрд в 2016 году).
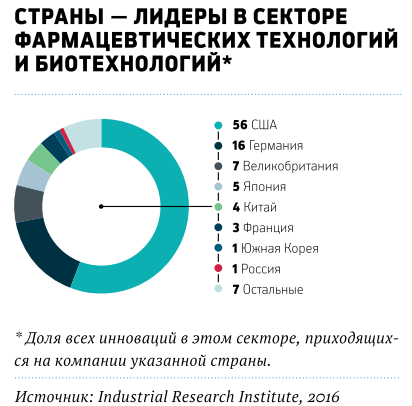
Однако доля расходов на исследования в общих тратах частного и государственного секторов на здравоохранение даже в развитых странах сравнительно невелика. В США — лидере среди стран по вложениям в R&D — их доля в 2016 году составляла 4,9% от общих расходов на здравоохранение, оцениваемых в $3,2 трлн. В России — 1,8% от общих расходов в $9,7 млрд, или 544 млрд руб.
Потребности медицины определяет клиническая картина мира. В XXI веке она складывается из сердечно-сосудистых и онкологических заболеваний, старческих недугов, наследственных и даже орфанных (редких) болезней разной этиологии. Кроме того, наука по-прежнему ищет способы борьбы с масштабными вирусными инфекциями, не поддающимися классической вакцинации (гриппом, ВИЧ-инфекцией), и новыми экзотическими — ТОРС, Эбола, Зика.
В первую очередь фармкомпании и государство вкладывают средства туда, где гарантирован успех в лечении и возврат вложенных средств. «Выбор актуальных направлений в медицине базируется на потенциале конечного продукта с точки зрения его эффективности, на запросе потребителя, которым может выступать государство как представитель пациентов, а также интересе частных компаний и инвесторов в реализации прорывных проектов с высокой окупаемостью», — отмечает генеральный директор компании Future Biotech Денис Курек.
В частности, основные силы российских разработчиков по заказу государства брошены на создание эффективного и доступного лекарства от рака — второй после заболеваний сердечно-сосудистой системы причины смертности в России. Ежегодный объем госзакупок на лечение онкозаболеваний превышает 60 млрд руб. — такие данные приводят в DSM Group. «Аудитория у болезни широкая, стоимость препаратов высока. Отдача от инвестиций в разработку лекарства от онкозаболеваний происходит довольно быстро», — говорит эксперт фармацевтического рынка, генеральный директор DSM Group Сергей Шуляк.
Достижения последних лет в области биологии, химии, иммунологии, клеточной биологии и других науках позволяют сделать рывок в области прикладного их применения в практической медицине. Рождаясь на стыке этих наук, медицинские биотехнологии в ближайшие 20 лет могут удивить человечество не меньше, чем, например, информационные технологии.
Иммунотерапия
Одной из самых перспективных технологий создания современных лекарств от онкологических и аутоиммунных заболеваний является биосинтез моноклональных антител (МКА). Близкие по своей структуре к человеческим иммуноглобулинам — белкам крови, являющимся одним из основных механизмов защиты организма от инфекционных заболеваний, МКА низкотоксичны и более безопасны по сравнению с традиционной химиотерапией.
Первый импортный иммунотерапевтический препарат ипилимумаб (TM Yervoy) нового поколения, который является моноклональным антителом, способным связывать и подавлять защиту клеток метастатической меланомы (рака кожи), был выведен на рынок в 2014 году компанией Bristol-Myers Squibb. Компания Biocad планирует в 2018–2019 годах выпуск в России препарата, действующего по тому же принципу, но более широкого спектра действия. Об этом ранее заявляла министр здравоохранения РФ Вероника Скворцова.
Сегодня стоимость лекарства в России — около 100 тыс. руб. за упаковку. Курс лечения с поддерживающим ипилимумаб препаратом того же класса и той же компании — ниволумабом (TM Opdivo) обойдется в два раза дороже. Импортные препараты пока монополисты нового рынка. Российские разработки призваны снизить стоимость жизненно важных лекарств. Программа «Фарма-2020» субсидирует разработки в этой области (см. диаграмму). В частности, первый российский препарат на основе МКА — ритуксимаб — Biocad выпустила в 2014 году в результате государственно-частного партнерства на средства федерального бюджета.
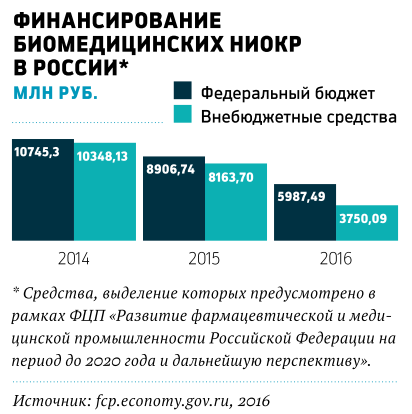
Стимулирование отрасли (с 2015 года препараты российского производства имеют существенные преференции в госзакупках ЛС) позволило российским технологиям серьезно продвинуться в создании лекарств нового поколения и потеснить препараты импортного производства. По данным DSM Group, в 2015 году в госзакупках по программе «Семь нозологий» доля препаратов российского производства выросла с 3 до почти 20%. В рамках этой программы наиболее дорогие лекарства для семи редких заболеваний, включая злокачественные новообразования кроветворной и лимфоидной тканей, централизованно закупаются на средства федерального бюджета. За последние два года значительно выросли объемы закупок, в том числе отечественных противоопухолевых препаратов, по государственной программе льготного лекарственного обеспечения (ОНЛС).
Вакцины против аутоиммунных заболеваний
Антицитокиновая терапия — последнее слово в лечении аутоиммунных заболеваний, при которых некоторые иммунные клетки, призванные защищать организм, начинают его убивать. Однако в ее современном виде у этой технологии есть очевидные недостатки — организм не всех больных на нее отвечает, нет надежных биомаркеров, которые позволили бы предсказать успех этой очень дорогой терапии.
Дальнейшее развитие метода, по словам научного руководителя Федерального исследовательского центра фундаментальной основы биотехнологии РАН, завкафедрой биотехнологии биологического факультета МГУ им. М.В. Ломоносова академика Константина Скрябина, связывают с созданием препаратов на основе биспецифических, как их называют, антител с заданными свойствами, или бинарных вакцин. Это биоконструкции на основе антител, образно говоря, с двумя руками. Одной антитело держится за поверхность «сошедшей с ума» иммунной клетки, а второй, как хоккейный вратарь в ловушку, ловит выделяющиеся из клетки вредные цитокины и нейтрализует их.
На рынке они появятся, вероятно, не раньше середины 2020-х годов. Создание таких лекарств — путь долгий и дорогой.
Предметом исследования являются не только сами антитела, но и мишени — деструктивная клетка или вещество, которое активирует ее деятельность и которое нужно нейтрализовать. «Определение мишени — важная часть инновации в создании лекарства», — говорит Константин Скрябин.
«Нужно понимать, о какой «сошедшей с ума» патологической клетке идет речь и с помощью какой мишени эту клетку можно отличить от здоровых клеток. Главное — это наличие адекватной мишени, открытой фундаментальными биологами, исследователями», — согласен медицинский директор Национальной иммунобиологической компании (входит в госкорпорацию «Ростех») Александр Власов.
Выращивание тканей
Существующие технологии уже позволяют выращивать ткани и даже целые органы за счет ресурсов самого организма (аутологичных клеток, широко известные стволовые клетки — их разновидность). Но главная проблема в том, что для клеточного строительства нужен матрикс — каркас, который в идеале по окончании строительства должен замениться восстановленной тканью и бесследно исчезнуть.
Разработка МГУ предлагает в качестве такого каркаса для наращивания ткани фиброин (белок) шелка тутового шелкопряда. До сих пор на рынке матриксов конкурировали синтетические биоразлагаемые полимеры, но использование природных материалов выглядит более перспективным. Первые результаты биопротезирования тонкого кишечника у крыс обнадеживают, что эта технология будет востребованной.
«Чтобы выращивать новые ткани и органы, например кожу или тонкий кишечник, клетки должны образовывать нужную структуру конкретного органа. Белок шелка тутового шелкопряда позволяет структурировать ткань», — отмечает Константин Скрябин. По его мнению, технология имеет большое будущее.
Генная инженерия
Наука не только научилась читать геном человека со всей наследственной информацией, но и нашла способ его редактировать, что открывает новые возможности для лечения онкологии, вируса иммунодефицита человека и моногенных заболеваний. Лидирует по использованию редактирования генома терапия ВИЧ-инфекции с шестью зарегистрированными на сегодняшний день клиническими исследованиями. «Перспективы применения редактирования генома безграничны. В области трансплантации органов и тканей, например, особое место занимают разработки по преодолению межвидовой гисто-
совместимости. «Отредактированные» животные, например свиньи, с учетом физиологии и архитектоники органов и тканей могут быть универсальными донорами для человека», — отмечают авторы доклада «Редактирование генома и возможности генной терапии в онкологии» фонда «Сколково».
Мировые медтехнологии, по словам академика Скрябина, перешли к превентивным мерам в отношении трудноизлечимых заболеваний. В начале 2000-х годов чтение генома обошлось в $3 млрд, сейчас технология позволяет это сделать за $1 тыс. Одна из американских компаний, специализирующаяся на этой услуге, анонсировала возможность получать всю генетическую информацию человека в течение двух часов по цене, не превышающей $100.
Результатом поиска на протяжении последних 20 лет подхода к проведению неинвазивной диагностики генетических заболеваний плода стала возможность на раннем сроке — уже после десятой недели беременности — определять свободные фрагменты ДНК из клеток плода в крови матери. Достаточно забора крови матери. В Европе сделано уже 400 тыс. анализов с использованием фетального материала, циркулирующего в материнском кровотоке, в Китае — 500 тыс. В России проведены пока только первые пять тысяч анализов. В стране нет зарегистрированного необходимого оборудования, иностранные аналоги очень дороги, поэтому услуга недоступна в повседневной медицинской практике. Кроме того, по словам Константина Скрябина, государственная система обязательного медицинского страхования (ОМС) оплачивает стандартные методики пренатальной диагностики, так называемого прокола — забора необходимых материалов околоплодной жидкости с проникновением инструментов в полость матки.
По словам исполнительного директора кластера биомедицинских технологий фонда «Сколково» Кирилла Каема, будущее за Big Data в медицине: «Собрав данные по большим популяциям населения, можно полностью изменить парадигму здоровья. Эти данные будут давать вероятностный прогноз о рисках и позволят заниматься профилактикой не только в традиционном виде, а делать конкретные вмешательства, которые позволят остановить развитие заболеваний».
Александр Власов ждет перспективных решений в области продления жизни и комфортного старения от западных специалистов. Фундаментальных исследований вопросов старения, по его словам, в нашей стране пока мало.

