
Технологии в серой зоне
Распространенная в России ситуация: небольшой, продвигаемый отдельными энтузиастами бизнес работает исключительно по недосмотру государства — у регулятора просто не дошли до него руки. Именно так происходило на протяжении нескольких лет с биотехнологическими компаниями, развивающими такие регенеративные медицинские технологии, как всевозможные клеточные методы омоложения, выращивание хрящевой ткани и кожи, 3D-принтинг органов и тканей. С 2004 по 2011 год клеточные технологии в России регулировались административным регламентом по медицинским технологиям. За это время было зарегистрировано около 30 медицинских разработок, половина которых приходилась на государственные научные и лечебные учреждения. После того как в 2011-м регламент аннулировали, клеточная индустрия оказалась без присмотра.
Закон № 180-ФЗ «О биомедицинских клеточных продуктах» готовили в Минздраве более шести лет, но принят он был летом прошлого года без единого подзаконного акта. В таком виде — без этих актов, то есть без возможности применения, — он и вступил в силу 1 января 2017 года.
За период «бесконтрольности» в стране появилось несколько подающих надежды компаний, которые получили гранты на разработки, нашли инвесторов, а некоторые даже выпустили на рынок первые клеточные продукты.
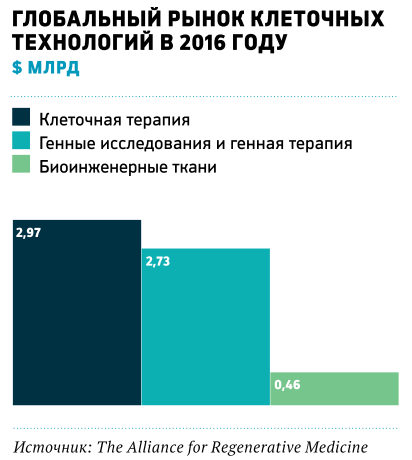
По оценке директора Центра исследований экономики и управления в здравоохранении бизнес-школы «Сколково» Юрия Крестинского, на рынке отечественных клеточных технологий, общий объем которого сегодня составляет 25–30 млрд руб., половина этих средств обращается в косметологических кабинетах. Речь обычно идет о перемещении жировой клетчатки пациента (липосакция, липофилинг и прочие способы). Если говорить о лечении, которое требуется по-настоящему больным людям, то весь этот сегмент эксперт оценивает примерно в $150 млн (8,5 млрд руб.). Сюда не включены так называемые стандартизированные клеточные препараты, которые поставляют фармацевтические компании; регулирование этого сегмента не отличается от препаратов химического синтеза и биотехнологических препаратов.
К наиболее широко применяемым в лечении клеточным технологиям, которые не связаны с фармацевтической промышленностью, относятся манипуляции с собственными клетками пациента, не требующие вмешательства в структуру клетки или выращивания культуры в лабораторных условиях. Это методы, основанные на использовании клеток пуповинной крови (для пациентов с ДЦП), а также пересадка донорского костного мозга при онкологических заболеваниях. В нескольких крупных онкологических центрах практикуют сложную технологию, которая позволяет «обучать» Т-лимфоциты больного распознавать опухоль. Этот метод позволяет спасать больных на поздних стадиях онкологических заболеваний. Но делают такие экспериментальные процедуры очень немногим, прежде всего по причине их дороговизны: стоимость одного курса — минимум один миллион рублей.
Более продвинутые клеточные технологии, которые принято считать медициной будущего (такие, как 3D-принтинг тканей и органов, создание лекарств для тяжелых наследственных заболеваний и развитие регенеративных методов замедления возрастных изменений), в России начали развиваться совсем недавно.
Крупнокалиберный закон
После публикации летом прошлого года нового российского закона его не устают критиковать и ученые, и представители биотехнологических компаний, которым по нему жить. Закон не учитывает скромных размеров индустрии и фактически приравнивает манипуляции с клетками человека к производству лекарственных средств. Во всяком случае, требования регулятора к ним почти одинаковы: сертификация, госрегистрация, заключение этического совета. Отдельной статьей предписывается создать специальное государственное учреждение для экспертизы биомедицинских клеточных продуктов. Но если на российском фармрынке, где действует подобное регулирование, работают несколько тысяч компаний — производителей десятков тысяч препаратов, то клеточными технологиями занимаются всего около десятка разработчиков, а их коммерческие продукты можно перечесть на пальцах одной руки. Огромное бюрократическое давление создается на бизнес, и без того имеющий очень высокие риски.
«Большинство препаратов на рынке клеточных продуктов — первые в своем классе, их рыночные перспективы в большинстве случаев скромные. Это не значит, что клеточные технологии не работают, — они работают, но пока дают не очень большой эффект в сравнении с более традиционными методами лечения. И обходятся дороже. Их нужно дорабатывать, следующие поколения будут эффективнее и дешевле», — пояснил РБК+ генеральный директор ПАО «Институт стволовых клеток человека» Артур Исаев. Тем не менее Исаев готовится в ближайшее время запустить процесс регистрации нового клеточного препарата для лечения тяжелого генетического заболевания — буллезного эпидермолиза: «Мы попробуем подать досье и быть одними из первых, зарегистрированных по новым правилам. Когда регистрацию полностью пройдут две-три компании, система заработает, станет понятно, чего от нее ждать».
Артур Исаев предлагает упростить регистрационные процедуры, предложенные в законе: «Оптимальным можно считать путь, по которому пошла FDA (контролирующий орган США. — РБК+). Они разрешили компании Fibrocell, которая параллельно с нами работает над своим клеточным препаратом от буллезного эпидермолиза, провести первую стадию клинических испытаний всего на двух пациентах, вторую — на шести, после чего при хороших результатах их препарат сможет выйти на рынок. Третью стадию они будут проводить после регистрации, когда препарат уже будет доступен пациентам».
«Новый закон нам ничего не даст и ничего не отнимет, ведь мы пока занимается только научной деятельностью, а она законом не регулируется. Жить в серой зоне — это было самым страшным. Когда у нас появится продукт, готовый к выходу на рынок, подзаконные акты уже будут приняты», — надеется Юсеф Хесуани, исполнительный директор лаборатории 3D Bioprinting solutions. Это проект крупнейшей в России частной лаборатории Invitro и резидент биотехнологического кластера фонда «Сколково». Хесуани надеется, что новый закон не приведет к утрате тех немногих наработок, которые уже создали российские биотехнологи. «Пока можно сказать только, что закон увеличит стоимость вывода на рынок разработок в этой области. Мы видим, что в странах, где регулирование менее жесткое, — Южная Корея, Австралия, клеточные технологии быстро развиваются, легче попадают на рынок, что привлекает инвесторов».
Надежда на смягчение
На то, что подзаконные акты несколько смягчат общий категоричный тон закона, а также снимут «ненаучные» запреты, надеются и ученые. «Очень плохо, что закон запрещает использовать эмбриональные стволовые клетки. В США и Европе полным ходом идут клинические испытания целого ряда препаратов на основе эмбриональных стволовых клеток — даже там, где это было сначала ограничено, теперь многие ограничения сняты. Мы со своим новым законом рискуем отстать навсегда», — рассказал РБК+ руководитель лаборатории генетических основ клеточных технологий Института общей генетики РАН Сергей Киселев (ученый входит в научно-технический совет Института стволовых клеток человека).
По словам Киселева, формулировки закона вводят в заблуждение, поскольку запрет на использования эмбриональных стволовых клеток (ЭСК) обусловливается недопустимостью умышленного создания человеческих эмбрионов с целью использования их в качестве сырья для клеточных продуктов. Между тем для получения эмбриональных стволовых клеток используют не какие-то специально созданные эмбрионы, а эмбриональный материал, оставшийся после процедур экстракорпорального оплодотворения.
Только в США, говорит профессор Киселев, каждую неделю утилизируют около 10 тыс. оплодотворенных бластоцитов (эмбрионов), а во всем мире их выбрасывают не менее 30 тыс.
«Сегодня плюрипотентные стволовые клетки можно получить для каждого пациента из его собственных тканей, а также из тканей доноров с помощью технологии репрограммирования клетки. Плюрипотентностью называется уникальное свойство эмбриональных стволовых клеток, из которых исследователи могли получать и олигодендроциты для лечения спинного мозга, и пигментный эпителий для терапии глаза, и инсулин-продуцирующие клетки. По сути, для каждого человека можно таким путем получить его эмбриональные клетки. Эта технология была удостоена Нобелевской премии 2012 года», — говорит профессор Киселев. Но чтобы убедиться, что в результате репрограммирования получены именно те клетки, которые нужны, необходимо сравнить их с образцом ЭСК. И тут закон, запрещающий использование последних, хотя и косвенно, будет тормозить развитие применения технологии репрограммирования, подчеркивает эксперт.
Отношение к клеточным технологиям вообще и эмбриональным стволовым клеткам в частности в мире менялось несколько раз; сегодня использование ЭСК разрешено в странах с наибольшим количеством биотехнологических компаний.
Без эмбриональных стволовых клеток были бы невозможны самые многообещающие прорывы в клеточных технологиях. В 2009 году ученые из университета города Ирвайн в Калифорнии в сотрудничестве с корпорацией Geron начали клинические испытания по пересадке ЭСК пациентам с травмами спинного мозга. В 2015 году успешно завершились испытания по использованию дифференцированных производных ЭСК человека для терапии наследственной дистрофии сетчатки глаза. Сейчас мультицентровое продолжение этих исследований проходит в США, Великобритании, Австралии, странах Азии. В 2014 году американская компания Viacyte начала клинические испытания лечения диабета с использованием клеток поджелудочной железы, полученных из эмбриональных стволовых клеток человека. Результаты будут известны в конце текущего года.
Американский закон
В США базируется половина из зарегистрированных в мире на конец 2016 года 772 компаний, занимающихся генными и клеточными технологиями.
В декабре 2016 года конгресс США принял медицинский закон (21st Century Cures Act), по которому в 2017 году на медицинские и биомедицинские исследования из федерального бюджета выделяется $4,8 млрд, из них $1,5 млрд — на дегенеративные заболевания центральной нервной системы, $1,8 млрд — на исследования рака головного мозга.
Кроме того, дополнительные средства выделены FDA для упрощения процесса допуска на рынок новых медицинских технологий и лекарств, в том числе клеточных. Альянс регенеративной медицины (США) уже назвал этот закон грандиозным прорывом, который позволит развиваться регенеративным медицинским технологиям еще быстрее. Упрощенный порядок доступа технологий позволит сократить путь от лаборатории до пациента и привлечь больше частных инвестиций.
Сегодня в США и большинстве стран ЕС использование эмбриональных стволовых клеток в научных исследованиях и лечении законодательно разрешено. Что не означает, что с тканями человека можно делать все что угодно. На самом деле работу с «человеческим» материалом внимательно отслеживают и жестко регламентируют ассоциации репродуктологов, устанавливающие нормы обращения с эмбрионами (как оставшимися после ЭКО, так и полученными в результате абортов). Чтобы начать какие-либо исследования с человеческими тканями или клетками, исследователь должен пройти комиссию этического комитета (действует при каждом университете) и получить разрешение.

