
Общие правила обращения лекарственных препаратов и медицинских изделий для членов Евразийского экономического союза (ЕАЭС) — России, Армении, Белоруссии, Казахстана и Киргизии — начали действовать с мая 2017 года. Объединение рынков будет идти поэтапно. И к 2025 году на территории союзных государств правила производства и реализации фармацевтических препаратов и медизделий должны быть полностью унифицированы.
Как в Европе
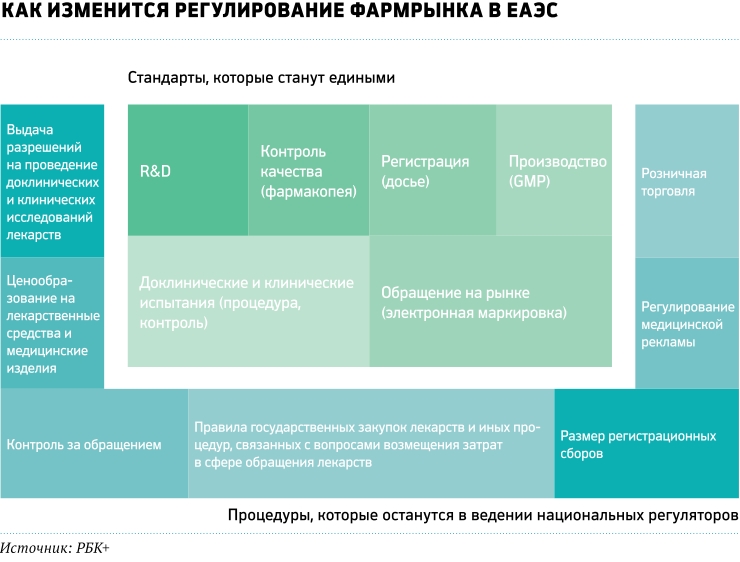
Пакет из 26 документов, включающий решения Совета Евразийской экономической комиссии (ЕЭК) и рекомендацию Коллегии ЕЭК, должен сделать фармацевтический рынок пяти стран, подписавших эти документы, похожим на европейский. Лекарства и медицинские изделия будут производиться и реализовываться по единым правилам. О том, что за основу взята европейская модель общего регуляторного пространства, говорили еще на стадии согласования новых принципов. В феврале этого года министр по техническому регулированию ЕЭК Валерий Корешков на встрече в Страсбурге с руководством Европейского директората по качеству лекарственных средств и здравоохранению (EDQM) рассказал о создании единой фармакопеи (свода стандартов, устанавливающих норму качества сырья для производства медицинских препаратов) в странах ЕАЭС. В перспективе принятие документа позволит унифицировать евразийские и европейские правила. «Мы ставим задачу добиться в ЕАЭС как минимум такой же свободы обращения качественных лекарств (как в ЕС. — РБК+), отвечающих потребностям здравоохранения и международной торговли», — заявил Валерий Корешков в ходе встречи в Страсбурге.
Все разработанные и вступившие в силу в мае нормативные акты — это документы прямого действия, то есть на территории всех пяти государств они не требуют принятия дополнительных законов для ратификации. По замыслу разработчиков, общее экономическое пространство снизит бюрократическое давление на фармацевтическую отрасль и упростит доступ качественной и современной продукции на рынок всех стран-участниц. Производителям обещано значительное снижение административных издержек, а пациентам — снижение цен на все основные лекарства и повышение их качества.
Оцифровка лекарств
С 1 января 2019 года будет введена единая электронная маркировка лекарств. Сейчас электронная маркировка введена только в Армении и Белоруссии, и у каждой страны она своя. Поэтому за ближайший год предстоит разработать единую систему в формате DataMatrix (двумерный матричный штрих-код) и создать так называемые шлюзы в национальных информационных системах для подключения к единой базе данных лекарственных препаратов экономического союза. Технологическая совместимость — одно из основных требований договора ЕАЭС.
Новая маркировка сделает прозрачным происхождение той или иной партии лекарств или медизделий, гарантировав их качество конечному потребителю, и параллельный экспорт, говорит исполнительный директор Союза профессиональных фарморганизаций (СПФО) Лилия Титова. Речь идет о практике ввоза в страну продукции без ведома производителя, что абсолютно законно, например, в Армении, но не допускается в других странах экономического союза. Часто источником таких поставок оказываются гуманитарная помощь или лекарства, закупленные международными организациями. Введение новой электронной маркировки не позволит совершать такие маневры незаметно.
До 31 декабря 2020 года производитель лекарств имеет право выбирать, по каким правилам регистрировать препараты — национальным или общим. Правда, потом зарегистрированные по старинке лекарства все равно придется перерегистрировать — 31 декабря 2025 года регистрационные свидетельства старого образца перестанут действовать. Еще одна отсрочка действует в отношении подтверждающих документов: до 31 декабря 2018 года при подаче досье на регистрацию производитель может показать не сертификат общего для ЕАЭС стандарта качества производства GMP, а местный документ, подтверждающий соответствие производственной площадки национальным требованиям по качеству. Предполагается, что вся процедура с момента подачи досье лекарственного препарата на регистрацию до выпуска его в обращение займет от семи до десяти месяцев.
«Единая для всех стран процедура регистрации пока не запущена, так как местные власти должны постановлением правительства утвердить размер госпошлин», — пояснила РБК+ Лилия Титова.
В России такой нормативный акт был принят еще в марте 2017 года. В Налоговый кодекс России внесены соответствующие изменения. Так, за проведение экспертизы лекарственного препарата для медицинского применения при регистрации по новым правилам производитель должен заплатить государству 325 тыс. руб., за подтверждение регистрации — 145 тыс., за приведение регистрационного досье в соответствие с требованиями ЕАЭС — 75 тыс. руб. Причем уплата пошлин в одной стране не освобождает от уплаты пошлин в другой.
Лечение партнеров
Основной проблемой для формирования единого фармацевтического пространства в пяти странах союза остается «двухслойная» структура регулирования, считают эксперты. Ведь кроме свода общих союзных правил остаются внутренние, а они зачастую противоречат друг другу от страны к стране. Например, неразрешенной проблемой остается правило «третий лишний» при бюджетных закупках лекарственных препаратов, работающее в России. Эта мера призвана повысить шансы отечественных производителей на участие в государственном заказе. В контексте открытого рынка она может сменить знак на противоположный, открыв огромный российский рынок госзакупок не самым известным фармпроизводителям из дружественных государств с более низкими ценами, чем у отечественных производителей.
«Правила взаимозаменяемости препаратов, которые разработаны в России лучше, чем в других странах, и правило «третий лишний» делают наш рынок более открытым для лекарств из других стран ЕАЭС, чем их рынки открыты для нас», — считает директор Института экономики здравоохранения НИУ ВШЭ Лариса Попович.
Система регулирования во всех странах ЕАЭС сильно отличается от российской, поэтому нашей стране придется значительно сильнее подстраиваться к единому регулированию, чем другим участникам соглашения. Например, никто не собирается отдавать предпочтение российским лекарствам в госзакупках, так как эти правила по-прежнему остаются на национальном уровне. Все это кажется экспертам несправедливым, учитывая, что Россия — единственный крупный фармрынок в регионе, где уровень потребления лекарств на порядок выше, чем в других странах союза.
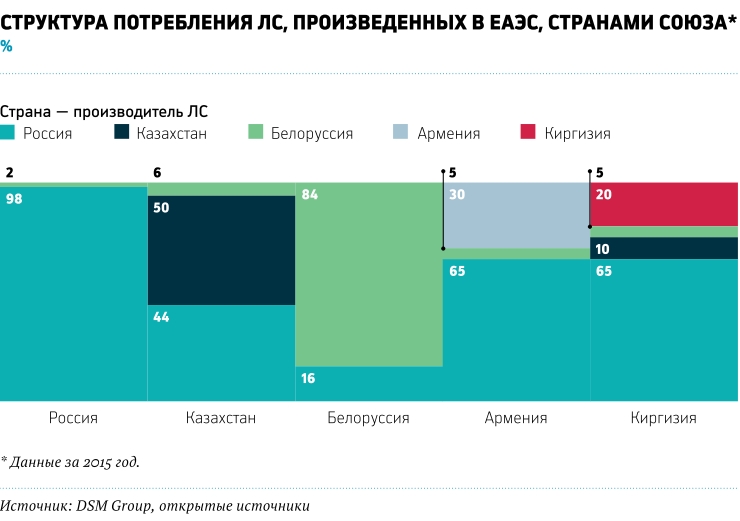
Общий объем фармрынка ЕАЭС, по данным DSM Group, в 2015 году превысил $20,6 млрд. Доля России достигает 85% и составляет около $17,4 млрд, Казахстана — 9%, или порядка $1,8 млрд, Белоруссии — 5%, или чуть более $1 млрд. Объемы фармрынков Армении и Киргизии составляют 0,5 и 1% соответственно от общего объема рынка (см. график).
«Для российского потребителя лекарств и производителей ждать положительных изменений в связи с объединением вряд ли приходится, — говорит Лариса Попович. — Родовые пятна в регулировании остаются, а количество обязательств увеличивается. Я бы не стала надеяться и на снижение цен для конечного потребителя. Вспомните, что правило «третий лишний» привело к росту цен, так как отбор осуществляется не по цене, а по стране происхождения». По мнению эксперта, Россия идет хорошо известным путем помощи странам из «своего» лагеря. Поэтому от объединения стоит ожидать скорее политический эффект, чем экономический.
Опыт ЕС
Единый рынок лекарственных средств (ЛС) в рамках Европейского экономического сообщества (ЕЭС) был создан в 1992 году. Сегодня он объединяет 27 стран. Общие правила его функционирования сначала принимались на уровне ЕЭС, а затем Европейского союза (ЕС). Постепенно они вытесняли национальное законодательство. На данный момент право ЕС проникло в регулирование почти всех стадий производства и продажи фармацевтических средств.
С 1995 года на территории ЕС действует единая система допуска ЛС на рынок, так называемая централизованная процедура. Однако государства сохранили в определенных случаях собственные национальные процедуры. Преимущество централизованной регистрации — действие разрешения во всех странах Евросоюза, если заключение относительно рассматриваемого нового лекарства дает специально созданное Европейское агентство по оценке лекарственных препаратов (European Medicines Evaluation Agency, EMEA). На основании этого заключения Комитет по патентованным лекарственным препаратам (Committee on Proprietary Medicinal Products, CPMP) Евросоюза принимает решение о допуске лекарства на рынок.
Однако единый порядок применим лишь в отношении определенного и очень ограниченного круга препаратов: являющихся в значительной степени инновационными, созданными в результате определенных биотехнологических процессов, обладающих новыми видами терапии и содержащих новые действующие вещества. Национальная процедура по допуску лекарств на внутренний рынок осуществляется на основе законодательства отдельной страны, в которой также отражены требования директив ЕС в фармацевтической сфере. При этом существует возможность упрощенной регистрации препаратов, разрешение на которую уже было получено в одной из стран ЕС.
По мнению авторов исследования Санкт-Петербургского филиала НИУ ВШЭ «Влияние права Европейского союза на регулирование фармацевтических средств государств-членов» (2014), внутренний рынок лекарственных препаратов в ЕС так и не был создан — для производителей и импортеров некоторых видов ЛС по-прежнему существует необходимость получать до 27 разрешений допуска на фармацевтический рынок. «Сложившаяся система может быть оптимизирована путем введения принципа европаспорта (Europass), который успешно применяется в других областях», — говорится в исследовании.

