
Структурные изменения отечественного рынка лекарств во многом обусловлены двумя факторами — действительно начавшейся масштабной локализацией производства и ростом доли дженерических лекарственных препаратов как в госзакупках, так и на коммерческом рынке. Второй фактор позволил несколько снизить ценовую нагрузку как на государство, занимающееся закупками медикаментов на бюджетные средства, так и на карман рядового пациента в условиях экономического спада и обесценения национальной валюты.
Если еще год назад речь шла о целевых показателях импортозамещения в размере 80% перечня ЖНВЛП (жизненно необходимые и важнейшие лекарственные препараты), то сейчас установленная Минпромторгом планка — 90%. Само импортозамещение происходит практически полностью за счет препаратов-аналогов. По данным DSM Group, на начало этого года общая доля дженериков достигла 59% в денежном выражении и 85% — в натуральном. А объем рынка оригинальных препаратов уменьшился в упаковках на 9% в сравнении с 2014 годом, при этом в денежном выражении остался на уровне предыдущего года — 365 млрд руб.
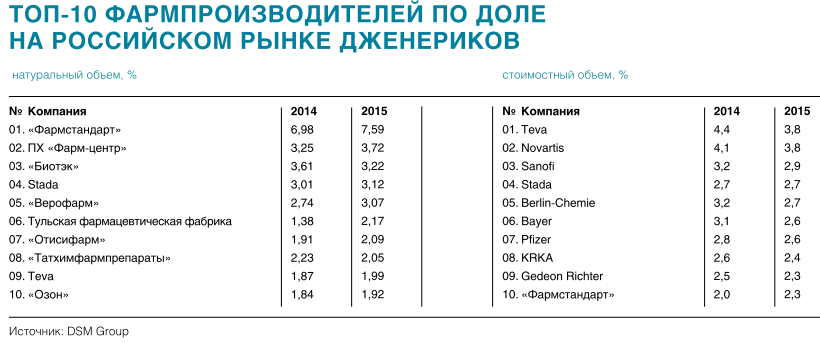
Наиболее ощутимый финансовый результат вывода на рынок биоаналогов и дженериков был достигнут в самой высокоценовой группе высокотехнологичных лекарств нового поколения. Так, можно говорить об импортозамещении противоопухолевых препаратов.
Но именно доступность дженерических препаратов из перечня ЖНВЛП самой низкой ценовой категории чуть было не привела к полному исчезновению с прилавков многих из них в конце прошлого — начале этого года. Невозможность повысить цену хотя бы до уровня рентабельности производства таких лекарств привела к остановке выпуска многих из них. Сейчас фармацевтическая промышленность добивается ослабления регулирования в данном сегменте и настаивает на выводе таких наименований из списка регулируемых по цене лекарств, чтобы сохранить их в аптечном ассортименте. Речь идет в первую очередь о безрецептурных средствах вроде мази от насморка или дешевых таблетках от головной боли.
Пока говорить о сколько-нибудь значительной доле дженериков, произведенных в России, не приходится, считают эксперты; значительного роста сегмента локализованных препаратов они ожидают в течение ближайших пяти лет. «Даже если завод был построен несколько лет назад, то после того как перерезали красную ленту, пройдет минимум полтора года до появления первой продукции на рынке, а до выхода на полную мощность — от трех до четырех лет», — поясняет исполнительный директор Ассоциации международных фармацевтических производителей (AIPM) Владимир Шипков.
Особая тема — качество дженериков. Два-три года назад истории пациентов, которых перевели с импортного дорогостоящего препарата на дешевый отечественный аналог, в результате чего их состояние ухудшилось, постоянно были в поле внимания СМИ и общественных организаций пациентов. «Надо признать, что, несмотря на наличие проблемы, особенно с биотехнологическими препаратами, накал страстей вокруг был преувеличенным и чисто эмоциональным», — считает сопредседатель Всероссийского союза пациентов Юрий Жулев. Погасить напряженность, по мнению эксперта, окончательно можно будет, когда «100% российских производителей будут работать по GMP (Good Manufacturing Practice)». Но уже сейчас правительство и Минпромторг приняли ряд мер для реального усиления контроля за качеством дженерических лекарств.
Так, с начала этого года вступили в силу поправки к закону «Об обращении лекарственных средств», регламентирующие понятие «взаимозаменяемость» биотехнологических лекарственных препаратов (повторить их значительно сложнее, чем произвести аналоги препаратов, полученных путем химического синтеза). Ситуация разрешилась с учетом мнения пациентских организаций, которые настаивали на том, что взаимозаменяемость — это не то же самое, что биоэквивалентность. Последний термин подразумевает сходство молекул. Новое определение взаимозаменяемости учитывает также терапевтическую эквивалентность, то есть лечебное воздействие препарата на пациента.
Кроме того, значительный шаг к повышению качества дженерических препаратов — введение с начала 2016 года отечественных стандартов GMP, уверены многие эксперты. Им должны соответствовать не только производственные мощности российских производителей, но и линии, находящиеся за рубежом. Сейчас активно дискутируется вопрос об организации выездных групп экспертов на заграничные производства, продукция которых идет в Россию.
В 2016 году доказывать соответствие качества производства отечественным нормам GMP должны только те иностранные производители, которые раньше не поставляли свою продукцию в нашу страну. С 2017 года такую процедуру должны будут проходить все иностранные поставщики лекарственных препаратов в Россию. Кроме того, усилена система фармаконадзора: все случаи побочных реакций пациентов на тот или иной препарат должны быть задокументированы и переданы в Росздравнадзор.
Обсуждение того, что считать отечественным препаратом, продолжается, так как большинство фармацевтических субстанций по-прежнему ввозят из-за рубежа. Несмотря на то что ранее Минпромторг неоднократно заявлял о необходимости обеспечить полный производственный цикл внутри Таможенного союза, сегодня у регулятора есть четкое понимание нецелесообразности 100-процентной локализации производства субстанций.
«Потенциал дженериков все еще недооценен в России, хотя это мировая практика, — считает Владимир Шипков. — Дженерики позволяют обеспечить лечением значительно большее количество пациентов и оптимизировать расходы здравоохранения на лекарственную терапию». Главная задача государства, подчеркивает эксперт, — организовать контроль качества, тогда курс на увеличение присутствия дженериков в структуре рынка можно только приветствовать.
